Questa settimana, la Food and Drug Administration (FDA) statunitense autorizzato l'uso di un singolo richiamo del vaccino covid-19 di Pfizer nei bambini di età compresa tra 5 e 11 anni, almeno cinque mesi dopo il completamento di una serie primaria di vaccinazioni. Il comitato consultivo del CDC dovrebbe approvare oggi la decisione.
Secondo la FDA, le prove alla base della sua decisione provenivano da un sottogruppo di 67 bambini che facevano parte di uno studio in corso e sono stati potenziati 7-9 mesi dopo la loro serie primaria. Hanno mostrato livelli di anticorpi più elevati un mese dopo il richiamo rispetto a prima del richiamo.
La decisione della FDA è audace per diversi motivi.
Mancanza di dati
Proprio quando la FDA dovrebbe richiedere dati migliori, l'agenzia abbassa i suoi standard.
Nessuno studio rigoroso in questa fascia di età ha dimostrato che una terza dose può ridurre esiti importanti come ricoveri e decessi: gli studi clinici randomizzati non sono stati condotti, nonostante Pfizer abbia guadagnato miliardi di entrate.
La decisione si è invece basata sulla presenza di “anticorpi neutralizzanti” perché facili da misurare e studiare. Non solo i livelli di anticorpi svaniscono rapidamente, ma non sono necessariamente correlati alla protezione.
Lo stesso della FDA sito web afferma che "i test anticorpali non dovrebbero essere utilizzati per valutare il livello di immunità o protezione di una persona dal covid-19". Eppure, questo è ciò che l'agenzia ha fatto.
Questo segue il precedente dati da New York durante l'impennata degli omicron che ha mostrato che l'efficacia del vaccino Pfizer nei bambini di 5-11 anni è crollata dal 68% a metà dicembre 2021, fino a solo il 12% entro gennaio 2022, ben al di sotto della soglia originale del 50% della FDA.
L'attenzione miope sugli anticorpi da parte delle autorità di regolamentazione dei farmaci e delle autorità sanitarie è stata a scapito di considerare altri importanti aspetti del sistema immunitario come i linfociti T CD4+ e le risposte natural killer, che svolgono un ruolo cruciale nella prevenzione delle infezioni e si pensa siano più durevole degli anticorpi. Sfortunatamente, questi dati sono stati in gran parte ignorati dalle autorità.
Il Dr. Peter Marks, direttore del Center for Biologics Evaluation and Research della FDA, lo ha riconosciuto i dati mostrano sempre più quella protezione dopo due dosi diminuisce nel tempo e che un terzo colpo potrebbe aiutare a rafforzare la protezione per i bambini nella fascia di età dai 5 agli 11 anni perché i "benefici superano i rischi".
Tuttavia, in termini di sicurezza, la FDA ha valutato solo circa 400 bambini che hanno ricevuto una dose di richiamo e qualsiasi danno grave e raro non sarebbe stato rilevato in un campione così piccolo.
Ignorando l'immunità naturale
È improbabile che l'autorizzazione di una terza dose per tutti i bambini di età compresa tra 5 e 11 anni – la maggior parte dei quali ha già un'immunità naturale – fornisca ulteriori benefici e possa esporli a danni inutili.
Il CDC statunitense segnalati che circa il 75% dei bambini e degli adolescenti ha evidenze sierologiche (anticorpi) da una precedente infezione e, quindi, ha già sviluppato una protezione robusta e duratura contro il covid-19.
Il governo del Regno Unito stimato che oltre l'85% dei bambini di età compresa tra 5 e 11 anni aveva contratto il covid-19 entro gennaio 2022 e che la loro immunità naturale acquisita avrebbe fornito protezione contro malattie gravi o future reinfezione.
Marty Makary, professore alla Johns Hopkins School of Medicine ha scritto nel Wall Street Journal è probabile che l'immunità naturale sia molto robusta nei bambini, dato il loro sistema immunitario più forte. Ha detto che se un bambino avesse già avuto il covid-19, "non ci sarebbero basi scientifiche per la vaccinazione".
Ha anche osservato che nessun caso di covid-19 è stato documentato né nel gruppo vaccinato né nel gruppo placebo nei bambini che erano stati precedentemente infettati da SARS-CoV-2 durante il processo di Pfizer, rafforzando il beneficio dell'immunità naturale.
Pannello consultivo
Il comitato consultivo per i vaccini e i prodotti biologici correlati (VRBPAC) non solo fornisce informazioni e competenze all'agenzia, ma conferisce credibilità e affidabilità al processo decisionale della FDA.
Tuttavia, la FDA non ha convocato il suo comitato consultivo questa settimana, affermando di aver già discusso dei booster in una riunione precedente e che un'ulteriore discussione non sarebbe di alcun beneficio.
Alcuni membri hanno espresso preoccupazione per il fatto che l'autorità di regolamentazione dei farmaci abbia ripetutamente portato avanti le decisioni sulle dosi di richiamo senza tenere discussioni pubbliche aperte e affermano che l'agenzia si affida sempre meno ai suoi esperti indipendenti per un consiglio prima di approvare i farmaci.
In un recente analisi, i ricercatori hanno dimostrato che solo il 6% dei farmaci approvati dalla FDA è stato esaminato da comitati consultivi nel 2021, in calo rispetto al 55% nel 2010 (vedi figura).
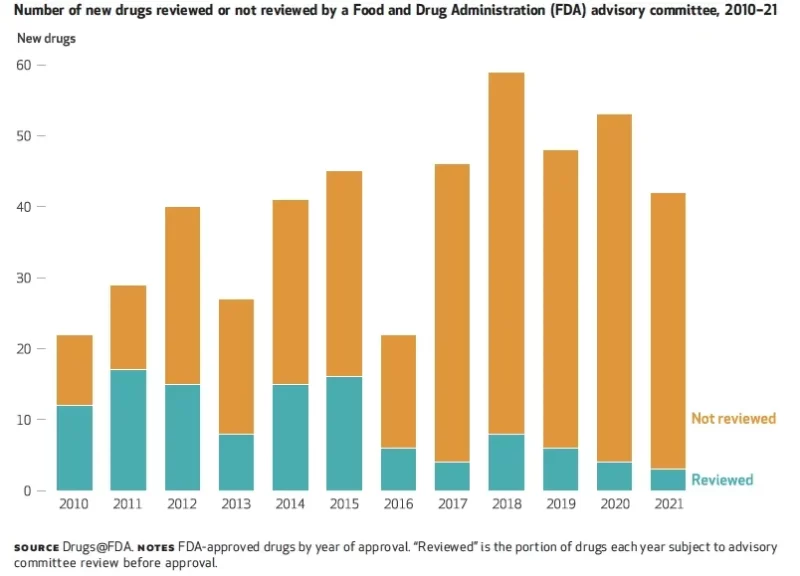
Se la fiducia del pubblico rispecchia queste cifre, le agenzie di regolamentazione hanno molta strada da fare per riconquistare la fiducia nei loro processi decisionali.
Assorbimento?
Nonostante la continua espansione dei booster, l'entusiasmo per i vaccini sembra diminuire. I vaccini contro il covid-19 non sono così efficaci nel prevenire l'infezione e la trasmissione come inizialmente sperato, e con un rischio così piccolo di malattie gravi nei bambini, i genitori stanno diventando meno convinti.
A recente indagine statunitense ha rilevato che quasi un terzo dei genitori di bambini di età inferiore a 5 anni ha affermato che "decisamente non" avrebbe vaccinato il proprio figlio in primo luogo, un altro 11% ha dichiarato che lo farà solo se necessario (obbligatorio) e il 38% prevede di aspettare per per vedere come il vaccino ha funzionato per gli altri.
Pfizer non ha ancora presentato la sua domanda alla FDA su un vaccino a tre dosi per bambini sotto i 5 anni, ma dovrebbe farlo nelle prossime settimane.
Originariamente pubblicato su d'autore site
Pubblicato sotto a Licenza internazionale Creative Commons Attribution 4.0
Per le ristampe, reimpostare il collegamento canonico all'originale Istituto di arenaria Articolo e Autore.









