Il Telegraph ha recentemente riferito che al pubblico è stato detto di interrompere l'assunzione di farmaci per la tosse e il raffreddore per timori sulla sicurezza riguardanti il farmaco, la folcodina, un sedativo della tosse oppioide.
Venti dei comuni farmaci per la tosse e il raffreddore, comprese le capsule Day and Night Nurse, sono stati ritirati con urgenza dal mercato su ordine delle autorità di regolamentazione dei farmaci a causa delle preoccupazioni su un rischio "molto raro" di anafilassi, un evento avverso potenzialmente letale.
L'annuncio del "ritiro dei medicinali di classe 2" tratto dal governo del Regno Unito sito web, è mostrato di seguito.

Quando si tratta di vaccini mRNA COVID-19, i doppi standard normativi non sono mai stati così evidenti.
L'anafilassi è stata identificata come un rischio importante dall'Agenzia europea per i medicinali, già nel dicembre 2020, nel CHMP (Comitato per i medicinali per uso umano) dell'EMA rapporto di valutazione sul vaccino Pfizer-BioNTech COVID-19, visto di seguito.
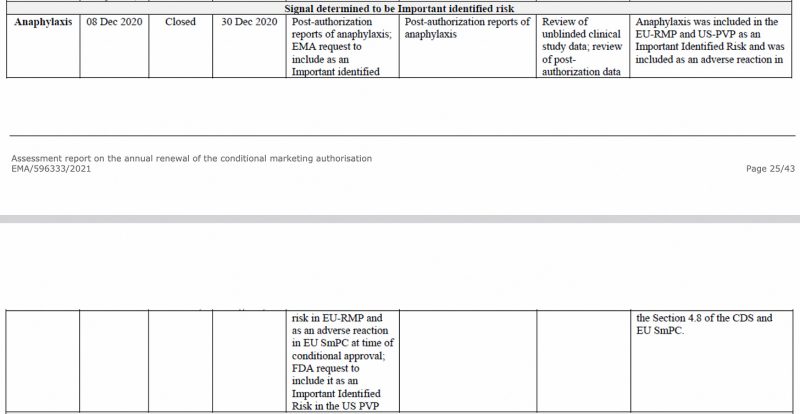
Inoltre, nel primo aggiornamento periodico sulla sicurezza dell'UE Relazione, che ho in precedenza analizzato, l'anafilassi è stata nuovamente segnalata come un importante rischio identificato.

In questo rapporto di farmacovigilanza, sono stati identificati 3,827 casi rilevanti (individui), dai dati successivi all'autorizzazione. Il paese con la più alta incidenza è stato il Giappone, seguito da Stati Uniti e Regno Unito.
Il numero più alto di casi segnalati è stato tra le donne, uno scioccante 3,182 casi rispetto ai 454 casi per gli uomini, con un'età media di 44 anni. Il fatto che siano stati segnalati 7 volte più casi per le donne non è una novità. Nel dicembre 2021, I analizzato la Pfizer si è preparata documento per la FDA, che copre il periodo di 3 mesi, da dicembre 2020 a febbraio 28, 2021 - in caso di anafilassi, le donne erano 8 volte più colpite.
Quindi, il 98 percento degli eventi avversi rilevanti (inclusi reazione anafilattica, shock anafilattico, reazione anafilattoide e shock anafilattoide) sono stati classificati come gravi!
Inoltre, per il 92% degli eventi, il tempo trascorso prima che si verificasse un evento avverso dopo la somministrazione del vaccino era inferiore a 24 ore.

Esiti fatali
Dei 3,922 eventi, 28 sono stati fatali e per l'incredibile cifra di 704 l'esito era sconosciuto. Non sono stati forniti numeri di casi per esiti fatali.

Casi per fascia di età
Dei 3,827 casi rilevanti (individui), 23 appartenevano alla fascia di età pediatrica e 3,021 alla fascia di età adulta.
Presenza di comorbidità
Ciò che è degno di nota è che circa i 2/3 di tutti i casi di anafilassi lo hanno fatto non avere eventuali comorbidità (problemi di salute sottostanti).

Dato ciò che è accaduto da quando sono stati lanciati i vaccini mRNA COVID-19, non sorprende leggere: “non sono state identificate nuove informazioni sulla sicurezza relativo al rischio di anafilassi con BNT162b2” (vaccino Pfizer-BioNTech COVID-19). Il motivo addotto (o la scusa dietro cui si nascondono) è che "questo rischio viene comunicato.. che include informazioni sulle azioni appropriate da intraprendere, come segue: "Come con tutti i vaccini iniettabili, devono essere sempre prontamente disponibili cure mediche e supervisione adeguate in caso di raro evento anafilattico successivo alla somministrazione del vaccino”.
Sotto Regolamento 174, Informazioni per gli operatori sanitari del Regno Unito, che è stato rivisto l'ultima volta nel dicembre 2021, si afferma quanto segue:

n infatti, proprio Il primo giorno del lancio del vaccino Pfizer-BioNTech COVID-19 nel Regno Unito, sono stati segnalati due casi di anafilassi e un caso segnalato di una possibile reazione allergica. Ciò non ha impedito all'MHRA di richiamare il prodotto: ha semplicemente aggirato il problema affermando che le persone che hanno una storia di allergie non dovrebbero assumere il vaccino.
Anche quando lo sapevano, gli ingredienti delle nanoparticelle lipidiche ALC-0159 e ALC-0315 di Pfizer/BioNTech non erano mai stati inclusi in nessun farmaco autorizzato prima. ALC-0159 contiene PEG (glicole polietilenico) che è noto per causare anafilassi.
È inequivocabile: l'anafilassi era un noto evento avverso pericoloso per la vita, più o meno nello stesso periodo in cui è stata concessa l'autorizzazione all'uso di emergenza per il vaccino Pfizer-BioNTech COVID-19. Tuttavia, poiché si tratta di un "vaccino iniettabile", in qualche modo ha ottenuto un pass gratuito da tutte le autorità di regolamentazione dei farmaci, non importa quanti dati dannosi si accumulino, quando invece uno sciroppo per la tosse o una capsula viene richiamato con urgenza sulla base di un "a rischio molto raro di anafilassi”.
Ripubblicato dall'autore substack
Pubblicato sotto a Licenza internazionale Creative Commons Attribution 4.0
Per le ristampe, reimpostare il collegamento canonico all'originale Istituto di arenaria Articolo e Autore.









